巴金森氏症的治療曙光|胚胎幹細胞為何極具道德倫理爭議?什麼是 iPSCs?再生醫學與幹細胞治療的未來潛力
Modified from photo by Joshua Niyogakiza on Unsplash.
大家最近還好嗎?
幾週前,《Nature》期刊同時刊登了兩篇關於巴金森氏症 (Parkinson’s disease) 的臨床醫學研究。
這兩篇論文的研究團隊,分別來自美國紐約 Memorial Sloan Kettering Cancer Center 與日本京都大學,分別利用兩種不同來源的幹細胞——胚胎幹細胞與誘導性多能幹細胞——兩個研究團隊不約而同地發現:幹細胞移植治療,有機會能夠改善巴金森氏症!
什麼是巴金森氏症呢?有哪些原因可能造成這個疾病?為什麼目前巴金森氏症的治療與多巴胺 (dopamine) 有關?這兩篇研究的未來發展會是如何呢?
除此之外,這篇文章也想要與你介紹,什麼是胚胎幹細胞?什麼是 iPSCs 誘導性多能幹細胞?為什麼胚胎幹細胞的研究會產生巨大的道德倫理爭議呢?
今天想要跟你分享這兩篇最新的、振奮人心的巴金森氏症細胞治療臨床報告!🤓
Photo by Philipp Deus on Unsplash.
巴金森氏症:目前仍然未知未解的醫學難題
巴金森氏症 (Parkinson's disease) 是一種神經性退化疾病。
在人類的大腦內,腦幹的最前方一個名為中腦 (midbrain) 的區域,裡面一塊被稱爲黑質 (substantia nigra) 的構造內,蘊含有高密度能夠分泌多巴胺的神經細胞 (dopaminergic neurons, 多巴胺神經元)。
而在巴金森氏症病人的大腦內,科學家們發現,大腦黑質內的多巴胺神經元嚴重退化凋亡——無法產生足夠的多巴胺,使後續的神經傳導迴路發生異常——導致病人出現像是顫抖 (tremors)、肢體僵硬 (rigidity)、行動緩慢 (bradykinesia) 與身體難以維持平衡 (postural instability)⋯⋯等運動神經異常的症狀。
是什麼造成中腦黑質內的多巴胺神經元衰退呢?
確切的原因目前依然未知,一般普遍認為可能的潛在因素有:遺傳、年齡或生活環境,也有可能是這些因子共同造成的。
此外值得留意的是,從流行病學的角度來說,全球的巴金森氏症案例有逐漸增加的趨勢:2021 年,全世界有近 1200 萬的巴金森氏症患者,這個數字是 25 年前的兩倍。預計到 2050年,全球可能會有將近 2500 萬的人患有此症。
但令人難過的是,巴金森氏症目前仍然是不治之症。
儘管可以透過服用多巴胺的前驅物質 (Levodopa) 來增加腦內的多巴胺;服用抑制劑 (MAO-B inhibitors) 來阻斷多巴胺被分解;甚至利用外科手術,在大腦深層安置電極 (deep brain stimulation, 深腦刺激) 以刺激大腦調整多巴胺神經迴路;然而,上述的方式主要還是以改善症狀為主。針對最源頭的問題:多巴胺神經元持續衰退凋亡,目前仍未有顯著效果的治療方式。
有沒有什麼方法,能夠直接針對多巴胺神經元凋亡做改變,進而達到治療的目的呢?
具有高度分化潛力、能夠發育成人體內多種細胞的幹細胞,自然而然地吸引了科學家們的目光。
如果能將幹細胞放到受損的大腦內,讓這些細胞分化成神經元,取代凋亡的多巴胺神經,讓大腦正常分泌多巴胺的話,或許能夠一勞永逸地解決巴金森氏症的難題。
也因此,幹細胞移植 (stem cell transplant)、再生醫學 (regenerative medicine)、細胞治療 (cell therapy) 這些領域,成為了過去數十年來,巴金森氏症治療研究的重要方向之一。
年齡標準化後,2050 年,全球巴金森氏症的預估盛行率(每 100,000 人)。
Reference: Su, D. et al. Projections for prevalence of Parkinson’s disease and its driving factors in 195 countries and territories to 2050: modelling study of Global Burden of Disease Study 2021. BMJ e080952 (2025).
什麼是胚胎幹細胞?極具爭議性的科學倫理道德議題
人類胚胎幹細胞 (human embryonic stem cells, 簡稱 hESCs),是一種具有高度分化潛力的幹細胞。他們能夠發育分化成我們體內幾乎所有的細胞,從神經細胞、免疫細胞、肌肉、骨骼、皮膚細胞⋯⋯等,全部都可以由胚胎幹細胞分化而成。
如此驚人的分化能力,使得胚胎幹細胞在細胞治療、再生醫學與疾病治療上展現了極大的應用空間——將胚胎幹細胞移植至發生病變的器官或部位、取代那些受損的細胞、讓器官重現健康正常的狀態。
目前有許多關於幹細胞治療的研究,正在積極進行當中,像是:第一型糖尿病 (type 1 diabetes, 胰島 β 細胞被破壞)、老年黃斑部病變 (age-related macular degeneration, 視網膜細胞老化)、心臟衰竭 (heart failure, 心肌細胞受損) 以及本篇文章的巴金森氏症 (多巴胺神經元喪失)⋯⋯等,都是目前胚胎幹細胞治療的應用範疇。胚胎幹細胞的研究與進展,讓這些目前無法被治癒的疾病,露出了一線痊癒的曙光。
但是,胚胎幹細胞有一個非常嚴重的議題:在道德倫理與法律宗教上極具有爭議。
為什麼會有爭議呢?最重要的原因在於,胚胎幹細胞的來源是人類胚胎 (embryo)。在受精後大約 3 – 5 天,此時的胚胎被稱爲 blastocyst,自 blastocyst 內,科學家們可以分離出一群特定的細胞,將這些細胞進行體外培養後,即可取得胚胎幹細胞,通常來說,一個胚胎可以獲得約 50 - 150 個胚胎幹細胞左右。
看到這邊,相信大家已經知道爭議點出在哪裡了——要取得胚胎幹細胞,就勢必得破壞胚胎。
然而,一個胚胎是有機會發育成爲人的。發育 3 – 5 天能不能被稱爲人?早期胚胎是否具有人的權利?該如何定義生命的開端?另一方面,我們又該如何看待飽受疾病折磨的病人?胚胎幹細胞的研究是有機會讓病人重獲健康的。病人的苦痛與生命是否也應該受到重視?這些都是爭議性極高,短期內難以達成共識的難題。
補充筆記:目前人類胚胎幹細胞的研究,胚胎的來源是體外受精生育機構 (in vitro fertilization clinics)。這些胚胎的取得過程,當然一定必須要經過捐贈者的同意,而且只有在確定這些胚胎不會被使用 (即:不會被用來植入子宮內) 的情況下,胚胎才能夠被作為科學研究用途。
什麼是誘導性多能幹細胞?再生醫學研究領域的重要里程碑
2006 年,來自日本京都大學的山中伸彌 (Shinya Yamanaka) 教授,在《Cell》期刊上,發表了一篇改寫教科書等級、改變再生醫學領域的極重要著作。
山中研究團隊們,僅利用 4 種蛋白質轉錄因子,便成功地將已經分化的成體細胞 (fibroblasts, 纖維母細胞) 重新誘導,使這些細胞再度具有如胚胎幹細胞般的分化能力。這些細胞被稱為誘導性多能幹細胞 (induced pluripotent stem cells, 簡稱 iPSCs)。
iPSCs 除了擁有與胚胎幹細胞相似的再生分化能力、擁有較低的免疫排斥風險以外,其最大的優勢在於,iPSCs 的取得過程完全不涉及胚胎的破壞,所以道德倫理爭議爭議性較低。
當然,iPSCs 並非完美無瑕。其最廣為人知的缺點,就是生產製造 iPSCs 的效率極低。除此之外,iPSCs 有可能會導致癌症腫瘤的形成 (tumorigenicity),也有可能引起其他不良的反應⋯⋯等。這些都是 iPSCs 在臨床治療上待需解決的問題。
補充筆記:製造 iPSCs 的 4 個轉錄因子 (transcription factors),分別是 Oct4、Sox2、c-Myc 與 Klf4。這 4 個因子也因此被合稱為 Yamanaka factors。這種重新改變基因的表現活性,而不影響 DNA 序列的過程,被稱為重新編程 (reprogramming)。
由於 iPSCs 的發明,山中伸彌教授的實驗研究證實了——即便是已完全分化的成熟細胞,仍能重新回到具有分化潛力狀態。在 2012 年,山中教授與英國的發育生物學家 John Gurdon 共同獲得了當年的諾貝爾生物醫學獎,獲獎原因是 "for the discovery that mature cells can be reprogrammed to become pluripotent"。
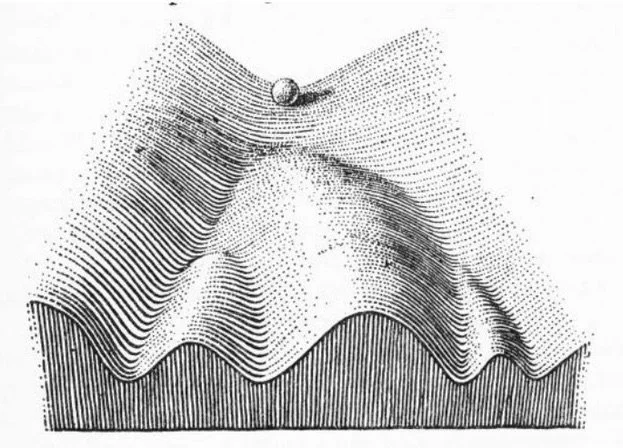
容我再次用之前文章分享過的圖與圖說。這張是幹細胞生物學課堂上一定會提到圖:經典的 Waddington’s epigenetic landscape。此概念為 1957 年時提出,將幹細胞比喻為山坡最上方的球,而細胞的分化就像是滑雪般往不同的下坡路線前進。山中伸彌教授團隊創造 iPSCs 的過程,就是利用reprogramming,把已經在山坡下的細胞,重新拉回到山坡上,使其再次具有分化成不同細胞的潛力。
Reference: Waddington, C. H. The strategy of the genes. A discussion of some aspects of theoretical biology. (George Allen & Unwin, Ltd., London, 1957).
巴金森氏症的治療曙光。這兩篇臨床研究是如何進行?
認識了什麼是 iPSCs、什麼是胚胎幹細胞以後,我們回到今天想跟你分享的這兩篇臨床醫學研究。
這兩篇文章同時發表在《Nature》期刊,分別來自日本與美國兩個不同的研究團隊,分別使用不同的幹細胞類型,用來治療同一種疾病:巴金森氏症。
來自日本京都大學的研究團隊,使用的正是 iPSCs——將 iPSCs 分化成多巴胺神經元的前驅細胞 (dopaminergic progenitors) 後,把此細胞移植入受試者病人的大腦內。
參與試驗的巴金森氏症患者有 7 位 (4 位男性 3 位女性,年齡介於 50 – 69 歲)。其中 3 位受試者接受了較低劑量的細胞 (5 million cells),另外 4 位則是接受較高劑量的細胞 (11 million cells)。
研究人員估計,最後真正在病人大腦內存活下來的多巴胺神經細胞,數量大約分別為 150,000 與 300,000 個左右(一般健康的大腦內通常具有約 300,000 個分泌多巴胺的神經細胞)。受試者們皆被給予免疫抑制劑,持續 15 個月。
日本京都大學研究團隊的臨床試驗設計流程。
Reference: Sawamoto, N. et al. Phase I/II trial of iPS-cell-derived dopaminergic cells for Parkinson’s disease. Nature (2025).
另一方面,來自美國紐約 Memorial Sloan Kettering Cancer Center (MSKCC) 的研究團隊,則是利用人類胚胎幹細胞——將源自胚胎幹細胞的多巴胺神經前驅細胞,移植入巴金森氏症病人的腦內。
該試驗總共招募了 12 位帕金森氏症病人 (9 位男性,3 位女性,平均年齡 67 歲)。其中 5 位受試者接受低劑量細胞 (0.9 million cells),另外 7 位接受較高劑量的細胞 (2.7 million cells)。
研究團隊預估,真正在大腦內存活下來的多巴胺神經細胞,分別約為 100,000 和 300,000 個細胞左右。受試者們同樣也在手術後被給予免疫抑制藥物,持續一年。
美國紐約研究團隊的臨床試驗設計流程。
Reference: Tabar, V. et al. Phase I trial of hES cell-derived dopaminergic neurons for Parkinson’s disease. Nature (2025).
兩篇研究分別持續觀察受試者們 24 個月與 18 個月,兩篇臨床研究皆沒有發現不良反應,也沒有產生癌症腫瘤的現象。
更令人振奮的消息是,美國的研究團隊還發現,甚至在停止使用免疫抑制藥物後,受試者的腦內多巴胺分泌量依然增加。顯示了移植入的神經細胞不僅存活下來,還能夠持續發揮預期的功能。
日本的研究團隊也同樣發現受試者腦內的多巴胺分泌量增加。除此之外,研究人員甚至還觀察到,受試者們的巴金森氏症狀,平均而言有改善的跡象(像是較少的顫抖、比較不需要他人輔助日常生活⋯⋯等)。
當然,這兩篇研究研究只是臨床試驗的 Phase I/II,受試者總共才 19 位。對於幹細胞是否真的能夠治療巴金森氏症,一切都還言之過早。
最後,值得注意的是,這兩篇臨床研究,都不是使用受試者本身的細胞 (allogeneic transplants)。這讓幹細胞治療巴金森氏症的未來,更具有「off-the-shelf」潛力。未來或許能像小分子或注射生物製劑一樣「ready-to-use」,以更方便迅速、更低的製造成本、造福更多的巴金森氏症病人。
Phase I/II 初期臨床試驗後,這兩篇研究下一步的計劃是?
在臨床試驗的各個階段中,Phase I 和 Phase II 主要是針對藥物的安全性與劑量做測試。檢測這個藥物是否會對人體產生不良的反應?在安全的前提下藥物最高劑量為何?唯有確認這個藥物安全無慮以後,才能夠進入到下一個臨床試驗階段 Phase III。
而今天這兩篇臨床研究報告,顯示了這兩種幹細胞治療,看起來是安全且沒有不良反應的。
那麼,研究團隊們的下一步計劃是什麼呢?
今年一月,美國紐約 MSKCC 研究團隊,與位於波士頓的生物科技公司 Bluerock Therapeutics 合作,即將於今年展開 Phase III 的臨床試驗。
除了預計會招募更多的受試者以外,也會規劃控制組與實驗組。這個完整的臨床試驗設計,相信將會提供研究團隊更全面的數據,來評估幹細胞治療巴金森氏症的效果。
而在日本京都大學的研究團隊,則是與位在大阪的製藥公司 Sumitomo Pharma 住友製藥株式會社合作。
預計會在今年,利用日本藥事機關獨有針對再生醫療產品的快速通關制度,申請 conditional approval 上市(不需完成 Phase III 即可申請,但需持續受密切評估,若不符預期仍會被下架)。
Photo by dahni pawitra on Unsplash.
當人類擁有改變生命的工具:再生醫療的未來潛力
再生醫學、幹細胞治療、組織工程 (tissue engineering) 這些領域,近年來,可以說是高速蓬勃發展。
前述提及的 iPSCs 誘導性多能幹細胞,之前與你介紹過的 CRISPR 基因編輯技術,再加上 3D 列印等工程技術的應用——日新月異的生醫科技,讓現代的科學家們能夠有機會去修補、替換人體內受損或老化的細胞與器官。
第一型糖尿病(胰島 β 細胞被破壞)、黃斑部病變(視網膜細胞老化)、心臟衰竭(心肌細胞受損)、異種器官移植(豬心臟移植人體)以及本篇文章的主角巴金森氏症(多巴胺神經元喪失)⋯⋯等,這些傳統藥物束手無策的疾病,紛紛因為再生醫學的進展,而出現了被治癒的可能。
甚至,這個再生醫學/重新編程 (reprogramming) 的概念與技術,還能夠再延伸,應用在之前與你分享過的「逆齡抗老化,延長增加人類壽命」的科學研究上。
延伸閱讀:
器官移植的新篇章?|全球首例豬心臟移植人體手術 x 什麼是 xenotransplantation?x 未來的器官移植會變成?
的確,再生醫學有著巨大無窮的潛力。
然而,就像許多過往的科學發展一樣,新知識或新技術的誕生,往往也伴隨著新的問題與挑戰。再生醫療的蓬勃發展,法規層面能不能跟上?相關配套措施能否有相對應的調整?
尤其最重要的是,再生醫學的治療研究,不僅僅關係到病人的生命,更常常涉及到複雜的道德倫理。
因此,在追求病人健康與福祉的前提下,透過跨領域的合作——生物學家、倫理學家、法規專家、臨床醫學專家、生醫工程學家——我們必須用更全面的角度來謹慎評估再生醫學,讓這個前景可期的領域持續穩定發展,研發出新的治療與解藥,讓更多人重拾健康的生活。
謝謝你看到最後!你覺得幹細胞治療是巴金森氏症的最終解答嗎?在生醫科技與日俱進的現代,人類逐漸有能力探索甚至介入生命的誕生,我們該如何看待這些潛在的道德倫理爭議呢?歡迎在底下留言/私訊給我,告訴我你的任何想法 😉
關注我的 Facebook 與 Instagram,每週帶你讀一篇生物學新知識,與那些平常的紐約生活 ✨
REFERENCE
THE BIOLOGIST|紐約生
如果覺得還不錯,記得分享給親朋好友唷!